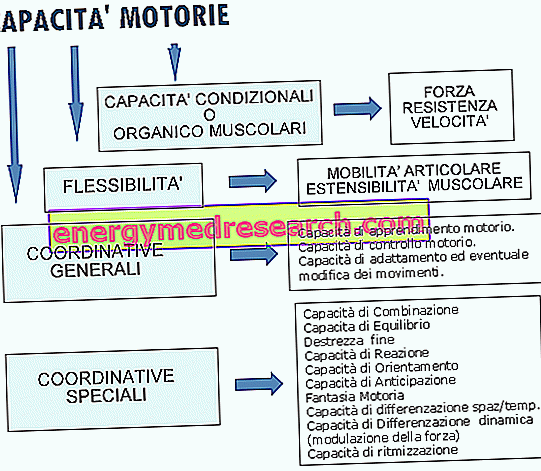
Ce este Evra?
Evra este un plasture transdermic (un plasture care eliberează medicamentul prin piele). Conține două substanțe active, norelgestromin (6 mg) și etinilestradiol (600 micrograme).
Pentru ce se utilizează Evra?
Evra este un contraceptiv feminin indicat femeilor în vârstă fertilă. Siguranța și eficacitatea acesteia au fost studiate la femei cu vârsta cuprinsă între 18 și 45 de ani.
Medicamentul poate fi obținut numai pe bază de prescripție medicală.
Cum să utilizați Evra?
Un plasture Evra este folosit în fiecare săptămână timp de trei săptămâni, în cea de-a patra săptămână fără ajutorul unui bandaj. Plasturile trebuie aplicate în mod regulat, adică întotdeauna în aceeași zi a săptămânii. Primul plasture se aplică în ziua 1 și se modifică în ziua 8; al doilea este schimbat pe data de 15. Intervalul fără plasture începe pe 22 și durează șapte zile. Acest interval nu trebuie să depășească șapte zile, altfel metode contraceptive non-hormonale, cum ar fi prezervativele, trebuie utilizate concomitent. Eficacitatea ar putea fi redusă la femeile care cântăresc mai mult de 90 kg.
Plasturele trebuie aplicat ferm pe fesă, abdomen (abdomen), partea superioară a brațului sau partea superioară a spatelui, dar nu pe piept sau pe pielea înroșită, iritată sau tăiată. Nu aplicați două plasturi de urme pe aceeași parte a pielii. Odată îndepărtat, plasturele utilizat trebuie eliminat în mod corespunzător. Pachetul este echipat cu un dispozitiv special în care trebuie să lipiți plasturele folosit înainte de al arunca. Pentru instrucțiuni complete privind utilizarea Evra, a se consulta prospectul.
Cum funcționează Evra?
Evra este versiunea patch-uri a pilulei (pilula contraceptivă orală combinată). Utilizarea unui plasture săptămânal în loc de o pastilă zilnică poate ajuta pacientul să utilizeze adecvat contracepția. Ingredientele active ale Evra sunt doi hormoni, etinilestradiol (un estrogen) și norelgestromin (un progestin). Ethinil estradiolul a fost utilizat pe scară largă în contraceptivele orale de mai mulți ani și norelgestromina este foarte asemănătoare cu un alt progestogen, care este de asemenea utilizat în unele contraceptive orale. Evra acționează ca "pilula" prin modificarea echilibrului hormonal al corpului pentru a preveni ovulația, modificarea mucusului cervical și subțierea endometrului (mucoasa uterului).
Ce studii au fost realizate pe Evra?
Evra a fost studiat în trei studii principale care au inclus 3000 de femei. În două studii, Evra a fost comparată cu contraceptive orale combinate: într-un studiu, comparatorul a fost un contraceptiv monofazic (pastile cu cantități fixe de ingrediente active în primele trei săptămâni ale ciclului de tratament), în timp ce celălalt studiu a fost trifazic cu variația cantității de ingredienți activi în timpul ciclului de tratament). Al treilea nu a comparat Evra cu alte medicamente. Toate studiile au durat un an (13 cicluri de patru săptămâni), iar măsura principală a eficacității a fost numărul de femei care au căzut în timpul sarcinii.
Ce beneficii a prezentat Evra în timpul studiilor?
În timpul celor trei studii, au fost înregistrate 15 sarcini la femeile care utilizează Evra, dintre care 12 s-au datorat eșecului metodei (atunci când sarcina survine în ciuda utilizării contraceptive adecvate). "Indicele Pearl" al lui Evra este deci 0, 90. Indicele Pearl este metoda standard pentru evaluarea eficacității contraceptivelor, care este numărul de sarcini nedorite la 100 de femei într-un an (echivalentul a 1 300 de cicluri). Indicii Pearl pentru contraceptivele orale au fost 0, 57 (monofazici) și 1, 28 (trifazici). Cinci dintre aceste sarcini au avut loc la femei cu greutate mai mare de 90 kg.
Care sunt riscurile asociate cu Evra?
În timpul studiilor, cele mai frecvente efecte secundare asociate cu Evra (observate la mai mult de 1 pacient din 10) au fost cefaleea, greața și hiperestezia la nivelul sânilor. Pentru lista completă a tuturor efectelor secundare, vezi prospectul.
Evra nu trebuie utilizat la femeile care sunt hipersensibile (alergice) la norelgestromină, la etinilestradiol sau la alți excipienți. Nu trebuie utilizat de femeile care au sau au avut tromboze venoase sau arteriale (cheaguri de sânge în vene sau artere), inclusiv un accident vascular cerebral sau atac de cord sau care prezintă factori de risc pentru tromboză (tensiune arterială foarte mare, diabet). cu afectarea vaselor de sânge, niveluri ridicate de colesterol sau predispoziție ereditară la tromboză). Nu trebuie utilizat la femeile care suferă de migrene cu aură (simptome vizuale sau alte simptome), unele tipuri de cancer sau sângerări anormale ale zonei genitale a căror cauză nu a fost diagnosticată. Pentru lista completă a limitărilor, consultați prospectul.
De ce a fost aprobată Evra?
Comitetul pentru produse medicamentoase de uz uman (CHMP) a hotărât că beneficiile Evra sunt mai mari decât riscurile sale pentru utilizarea ca contracepție feminină și a recomandat acordarea autorizației de introducere pe piață.
Mai multe informații despre EVRA
Comisia Europeană a acordat Janssen-Cilag International NV o autorizație de introducere pe piață pentru Evra, valabilă pe întreg teritoriul Uniunii Europene, la 22 august 2002. Autorizația de introducere pe piață a fost reînnoită la 22 august 2007.
Pentru versiunea EPAR completă a Evra, faceți clic aici.
Ultima actualizare a acestui rezumat: 06-2008