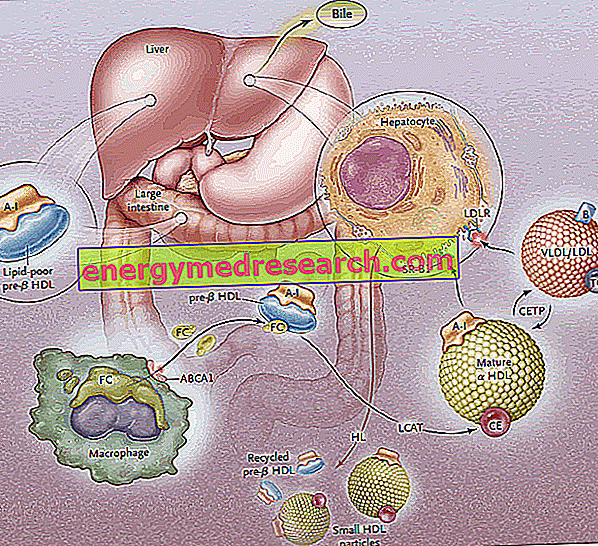
Transportul colesterolului invers (RCT) este procesul prin care colesterolul este îndepărtat din țesuturile periferice, prin încorporarea acestuia în lipoproteine HDL și transportul ulterior către ficat pentru excreția biliară.
Celulele periferice, ca toate celulele ne-intestinale sau hepatice, nu pot degrada excesul de colesterol; prin urmare, pentru menținerea homeostaziei celulare, prezența unui mecanism dedicat îndepărtării colesterolului din celule este esențială. Acest mecanism, destinat recuperării hepatice a excesului de colesterol periferic, se numește "transportul colesterolului invers" (RCT: transportul colesterolului invers ).
Să examinăm procesul în detaliu.
Biosinteza lipoproteinelor HDL trece prin sinteza și secreția inițială a principalelor componente ale proteinei (apoproteine), urmată de obținerea extracelulară a lipidelor (fosfolipide și colesterol) care conduc la asamblarea și generarea de particule HDL mature.
Prima etapă a transportului invers al colesterolului constă în producerea, de către intestin și ficat, a precursorilor discoid de HDL, care pe suprafața lor expun apoproteine (în principal ApoA-I); astfel se eliberează precursorii de HDL numiți pre-B-HDL, care includ cantități foarte mici de colesterol și lipide, în special fosfolipide. Prezența acestor molecule precursoare la nivelul periferic promovează transferul excesului de colesterol liber (FC) - scurs din celulele țesuturilor periferice - la apo AI, prin intervenția unui transportor de membrană denumit caseta de legare ATP A1 (ABCA1 ). Acest transportator este situat pe suprafața celulară și în membranele Golgi și poate transporta lipidele de la aparatul Golgi la membrana celulară, facilitând efluxul lor. În acest moment, de îndată ce colesterolul liber intră în HDL nativ, intervine o enzimă din plasmă de origine hepatică, denumită plasma lecitină-colesterol aciltransferază sau pur și simplu LCAT; această enzimă transformă colesterolul liber încorporat în pre-B-HDL în esteri de colesterol, transformând pre-B-HDL în forma lor a-HDL matură; în practică, acumularea continuă a colesterolului în miezul lipoproteinelor transformă HDL discoid în particule sferice și pline, care pot în continuare să achiziționeze apoproteine din particulele de lipoproteine bogate în trigliceride și să se amestece împreună. În întregul proces, apolipoproteina AI joacă un rol-cheie, stimulând atât activitatea transportorului ABCA1, cât și cea a LCAT. Deoarece ApoAI este apolipoproteina cea mai răspândită în HDL, concentrația sa plasmatică este direct legată de nivelurile de colesterol HDL.
NOTĂ: procesul de esterificare este esențial pentru a preveni redifuzarea colesterolului de la HDL la membrana plasmatică; acest mecanism exploatează acidul gras în poziția doi prezentă în moleculele de fosfatidilcolină.
Procesul de esterificare mediat de LCAT transformă apoi moleculele pre-B-HDL în formă sferică "matură" a-HDL. Aceste lipoproteine sunt transportate apoi în ficat, unde eliberează colesterolul, în conformitate cu două căi distincte.
În primul caz, HDL bogat în colesterol esterificat produce această lipidă lipoproteinelor bogate în trigliceride (lipoproteine foarte mici și de joasă densitate), apoi interceptate de către ficat de receptori specifici (LDL-R) și îndepărtați din circulație. Scopul este de a canaliza colesterolul periferic la nivelul ficatului prin sistemul receptorilor LDL, astfel "descărcând" HDL-ul din excesul de colesterol la nivelul periferic, astfel încât să îl pună din nou la dispoziție pentru a îl primi de la țesuturi; goliti de colesterol, HDL accepta trigliceride in schimb si acest lucru se face datorita proteinei de transfer al esterului de colesterol (CETP). Sarcina acestei proteine este, prin urmare, de a promova redistribuirea și echilibrul dintre colesterolul și esterii trigliceridelor dintre resturile HDL, LDL, IDL, VLDL, chilomicron și chnomicron, ceea ce duce, ca rezultat net, la o îmbogățire în trigliceride ale HDL, în detrimentul esterilor de colesterol, și o reducere a dimensiunii HDL.
Cea de-a doua cale implică receptori hepatici SR-B1 pentru HDL bogat în colesterol esterificat, în absența degradării concomitente a porțiunii proteice a HDL, care este apoi reciclată. În practică, această enzimă vă permite să goliți HDL din conținutul lor și să regenerați noul pre-B-HDL. O parte din HDL și ApoA-I este totuși internalizată și degradată la nivelul lizozomial, atât în celulele hepatice, cât și în cele renale. Absorbția mediată de SR-B1 este făcută mai eficientă prin activitatea lipazei hepatice, capabilă să transforme HDL care hidrolizează fosfolipidele de suprafață și permițând curgerea colesterolului esterificat de către miezul lipoproteinei față de membrana plasmatică (se presupune, printre în plus, că ApoE este implicat în absorbția selectivă, deoarece șoarecii cu deficiență pentru gena ApoE prezintă o reducere a eficacității acestei căi). SR-BI se exprimă predominant în ficat, suprarenale și ovare.