Proteinele
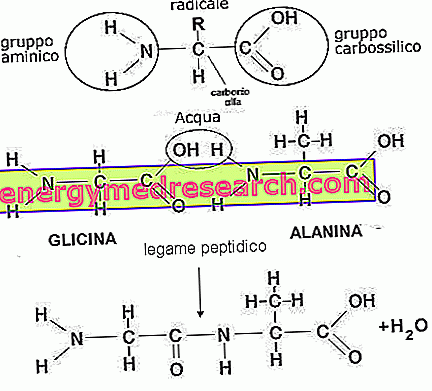
Proteinele sunt molecule polimerice compuse din mai mult de 100 de aminoacizi legați prin legături peptidice (lanțurile de aminoacizi mai scurte sunt numite polipeptide sau peptide); structura proteinelor poate fi mai mult sau mai puțin lungă, pliată pe sine și fixată la alte molecule (factori care determină complexitatea acesteia și caracterizează funcția sa biologică). Aceste structuri pot fi clasificate în: structura primară, structura secundară (α-helix și foaia β), structura terțiară și structura cuaternară.

Funcțiile proteinelor
În natură, proteinele îndeplinesc multe funcții, iar cea mai cunoscută este cu siguranță cea structurală; credeți că fiecare matrice de țesuturi a corpului nostru se bazează pe un mozaic de schelet sau polimer format de peptide (de exemplu fibrele musculare, matricea osoasă, țesutul conjunctiv și, din anumite puncte de vedere, chiar sângele).
Nu mai puțin importantă este funcția bioreglementării și a medierii chimice / hormonale, de fapt proteinele sunt constituenții de bază ai enzimelor și a multor hormoni.
În sânge, proteinele joacă, de asemenea, o importantă funcție de transport; este cazul hemoglobinei (transportul oxigenului), transferinei (transportul fierului), albuminei (transportul moleculelor lipidice) etc.
Încă în fluxul circulator, proteinele se dovedesc utile ca apărare imună; ele constituie ANTICORPI, molecule esențiale produse de limfocite utile în răspunsul organismului împotriva agenților patogeni.
În cele din urmă, proteinele - dar mai precis aminoacizii - pot fi utilizate în scopuri energetice prin neoglucogeneză hepatică și furnizează 4 kilocalorii (kcal) pe gram. Acesta este un proces destul de complicat care, prin intermediul transaminării și dezaminării, permite organismului să producă glucoză în condiții de hipoglicemie (posibil induse de post, efort intens muscular și / sau prelungit, afecțiuni clinice patologice sau adverse etc.). Unii aminoacizi neoglucogeni pot fi de asemenea cetogenici, astfel încât conversia lor duce la eliberarea moleculelor de acid numite corpuri cetone.
NB. Funcția energetică a proteinelor ar trebui să fie marginală și subordonată cu cea a zaharurilor și a grăsimilor.
Aminoacizi
Aminoacizii sunt molecule cuaternare compuse din carbon, hidrogen, oxigen și azot. Sunt cunoscute mai mult de 500 de tipuri și combinația lor diferențiază nenumărate forme de peptide. L-aminoacizii obișnuiți sunt 20: alanină, arginină, asparagină, acid aspartic, cisteină, acid glutamic, glutamină, glicină, histidină, izoleucină, leucină, lizină, metionină, fenilalanină, prolină, serină, treonină, triptofan, și valina . Din metabolismul acestora din urmă, este posibil să se obțină o gamă largă de aminoacizi ne-obișnuiți sau ocazionali care constituie în principal hormoni, enzime sau molecule intermediare (carnitină, homocisteină, creatină, taurină etc.).
Printre aminoacizii obișnuiți, unii NU pot fi sintetizați de organism și se numesc ESENȚIALI; pentru omul adult sunt 9: fenilalanină, leucină, izoleucină, lizină, metionină, treonină, triptofan și valină . La copii, în toate sunt 11; cele precedente sunt adăugate: histidină și arginină .
Alte clasificări ale aminoacizilor sunt: bazate pe polaritatea lanțurilor lor laterale (polar neutru, polar neutru, încărcături acide, încărcături de bază) sau bazate pe tipul de rădăcină (hidrofob, hidrofil, acid, bazic, aromatic).
Aminoacizi cu catenă ramificată
Printre cele esențiale se numără și trei aminoacizi numiți lanțuri ramificate (BCAA), respectiv: leucină, izoleucină și valină ; particularitatea care distinge aminoacizii cu catenă ramificată de ceilalți este reprezentată de o cale metabolică diferită a producției de energie.
După cum sa explicat deja, după transaminarea-deaminare, majoritatea aminoacizilor pot fi utilizați pentru neoglucogeneză și pot intra în ciclul de Krebs sub formă de oxalacetat sau piruvat . În cele din urmă, dacă ar exista o nevoie reală, unii dintre aminoacizii prezenți în sânge ar intra în hepatocite hepatice și vor ieși ca glucoză; pentru aminoacizii cu catenă ramificată nu o face. În comparație cu alții, BCAA sunt molecule DIRECT utilizate de către mușchi, iar această particularitate le face mult mai eficiente în producerea și conversia directă a energiei pentru reumplerea depozitelor de glicogen; este de la sine înțeles că, dacă organismul este suficient de hrănit, catabolismul aminoacizilor ramificați reprezintă o porțiune neoglucogenă aproape irelevantă; glucoza rămâne întotdeauna principala sursă de energie, prin urmare, în condițiile de zahăr din sânge și rezervă de glicogen SUFFICIENTI, chiar și în timpul performanței unei performanțe atletice obișnuite, nu există niciun motiv să se teamă că mușchiul are nevoie de un exces de aminoacizi cu catenă ramificată.