Trypsina și chymotripsina sunt două enzime cheie în digestia proteinelor alimentare. Ambele sunt produse și secretate ca zymogeni, adică în formă inactivă, din pancreas; precursorul zymogenic al tripsinei este numit trypsinogen, în timp ce cel al chymotrypsinei este numit chymotrypsinogen.
Trypsina și chymotripsina aparțin familiei mari de enzime proteolitice (implicate în digestia proteinelor) și subgrupului endopeptidazei. Aceste substanțe - inclusiv pepsină gastrică și elastază pancreatică - atacă legăturile peptidice din lanțul de aminoacizi, ducând la fragmente moleculare mai mici. Enzimele aparținând celui de-al doilea grup, cele ale exopeptidazelor, completează activitatea tripsinei și chymotrypsinei, detașând aminoacizii individuali de la capetele lanțului peptidic; aparțin acestei familii carboxipeptidelor pancreatice (A1, A2 și B, care atacă capătul carboxilic), dar și aminopeptidazele (care atacă capătul amino terminal) și dipeptidazele, atât produse, cât și secretate de mucoasa intestinului subțire. Unele carboxipeptidaze, similare cu cele observate pentru tripsină (tripsinogeni) și chymotrypsin (chymotrypsinogen), sunt secretați de pancreas într-o formă inactivă. În toate cele trei cazuri enzima implicată în procesul de activare enzimatică este enteropeptidaza, o proteină produsă și secretată de celulele mucoasei duodenale; mai specific, enteropeptidaza este specifică pentru tripsinogenul care, odată transformat în tripsină, activează de asemenea celelalte enzime proteolitice, incluzând același tripsinogen.
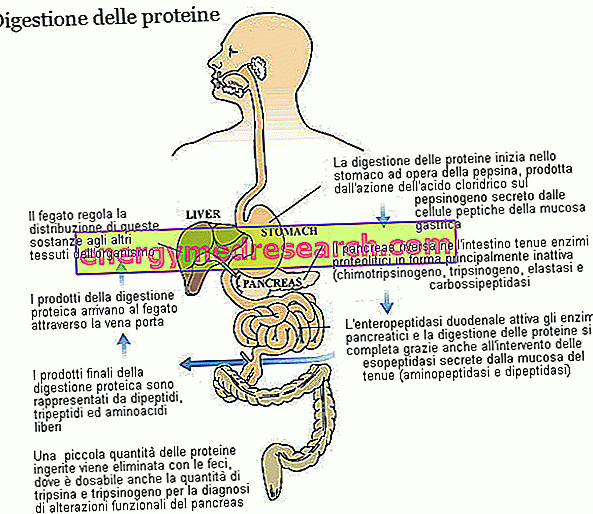
Diferențele funcționale între tripsină și chymotrypsin se referă pur și simplu la specificitatea lor, adică capacitatea de a recunoaște și separa numai legăturile formate de aminoacizi specifici. Trypsina intervine în principal pe legăturile peptidice care implică aminoacizi bazici (cum ar fi arginina și lizina), în timp ce chymotripsina predomină în mod predominant legăturile care implică tirozină, fenilalanină, triptofan, leucină și metionină.
Datorită diferitelor enzime proteolitice, cu contribuția acidității gastrice, proteinele dieta - inițial formate din câteva zeci de aminoacizi - sunt descompuse în dipeptide, tripeptide și aminoacizi liberi, toate substanțele ușor absorbabile care din capilarele mucoasei intestinale sunt transportat la ficat.
Trypsin și chymotrypsin în materiile fecale
Determinarea chymotripsinei și a tripsinei în scaun este utilizată și a fost, în primul rând, în trecut, ca un test indirect al capacității funcționale a pancreasului exocrin. Dacă ceva la nivelul acestei glande nu funcționează corespunzător, este logic să se aștepte la o sinteză redusă de tripsină și chymotrypsin, care va fi, de asemenea, deficitară în materiile fecale. Testul are o bună sensibilitate, dar este împovărat de riscul real al falselor pozitive și al negativelor false. Utilizarea laxativilor scade, de exemplu, concentrația de enzime în materiile fecale, în timp ce aportul de extracte digestive pancreatice (cum ar fi pancreatinul) sau legume (de exemplu, tulpina de ananas, papaya, papain și bromelaina) sunt cauza unor rezultate negative false. De asemenea, flora bacteriană intestinală are o ușoară influență asupra cantității de tripsină și chymotripsină care ajung neschimbate în materiile fecale; din acest motiv, utilizarea antibioticelor poate produce false negative; dimpotrivă, în prezența diverticulozei și a altor condiții care favorizează proliferarea bacteriană, pot fi înregistrate rezultate fals pozitive.
O aplicație clasică a testului de tripsină și chymotripsină în fecale este detectarea insuficienței pancreatice la pacienții cu fibroză chistică. Una din consecințele acestei boli este afectarea transportului normal de tripsină și alte enzime digestive de la pancreas la duoden; din acest motiv, la naștere, materiile fecale ale copilului care suferă de fibroză chistică sunt deosebit de compacte, până la punctul de a provoca obstrucție intestinală. Ca urmare, se înregistrează în special cantități mici de chymotripsină și tripsină în meconiu.